Research Topics [1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24]
13. 幼若ホルモン (JH) 量の増加とJHシグナル経路の腹部での活性化が,シロアリの幼形生殖虫の生殖腺発達を促す
シロアリの巣(コロニー)には,形態や行動が異なるカーストが存在します。各カーストが異なるタスクを担い,個体間で分業をすることで統率のとれた社会が構築されています。特に繁殖の分業は,社会構造を維持する上で最も重要な特徴であると言えます。シロアリの繁殖カーストには,有翅虫に由来してコロニーの創設を担う一次生殖虫の他に,彼らからコロニーを引き継ぐ幼形生殖虫(ネオテニック)が存在します(図1)。幼形生殖虫は,幼形形質を保持したまま,腹部にある生殖腺を顕著に発達させています(Saiki & Maekawa, 2011)。しかしながら,どのような発生制御が「腹だけオトナ」の特徴的な形態を発達させるのかは分かっていません。シロアリのカースト分化の中枢因子である幼若ホルモン(JH)は(トピックスVなど参照),成虫期には重要な生殖腺刺激ホルモンとして働くことが知られています。そこで,JHが幼形生殖虫の特殊な形態変化の主要因子である可能性を,ヤマトシロアリを用いて検証しました(Saiki et al. 2015)。なお幼形生殖虫は,異なる発生ステージから分化することが知られており,ニンフ・ワーカーから分化した個体を,それぞれニンフォイド・エルガトイドとよびます。
まず,ヤマトシロアリの幼形生殖虫(ニンフォイド・エルガトイド)と脱皮前の個体(ニンフ・ワーカー)の体内のJH量を,高速液体クロマトグラフ質量分析計を用いて測定しました。その結果,幼形生殖虫のJH量は,脱皮前の個体に比べて90倍以上も高いことが示されました(図2)。続いて,JHの核内受容体[Methoprene-tolerant (Met)]を含むシグナル経路の遺伝子発現を調べました。各遺伝子の発現量は,JHが体の各部位で特異的に働いている可能性を検証するために,頭胸腹の3つの部位で測定しました。幼形生殖虫を含む様々な発生ステージの個体を使って解析したところ,脱皮直後および成熟した幼形生殖虫の腹部において,どの遺伝子も顕著に高発現することが明らかになりました(図3,Met遺伝子の結果のみ示す)。最後に,JH受容体遺伝子Metの機能解析を行いました。RNA干渉法を用いてニンフのMet遺伝子の発現を抑制した上で,幼形生殖虫への分化誘導を行なったところ,分化した幼形生殖虫の卵巣サイズは,コントロールと比べて違いが見られませんでした。しかしながら,Met遺伝子の発現を抑制した場合には,幼形生殖虫の卵黄前駆タンパク質(ビテロジェニン)遺伝子の発現が有意に低下することが示されました(図4)。
以上のことから,幼形生殖虫の分化過程では,(1) 急激にJH量が増加して,(2) 腹部でのJHの受容とシグナル経路の活性化が生じ,(3) Metを介してビテロジェニンの合成が促進された結果,顕著な生殖腺の発達が生じていると考えられます。このような部位特異的なJHの使われ方が,それぞれのカースト分化に伴う特徴的な器官発達に強く影響する可能性があります。今後は,他のカーストや他種のシロアリでの解析も進めて,この考えを確かめる必要があります。[齊木亮太,2015年3月19日]
<参考文献>
Saiki R & Maekawa K (2011) Sociobiology, 58: 499-511.
Saiki R, Gotoh H, Toga K, Miura T & Maekawa K (2015) Insect Molecular Biology (in press).

図1.ヤマトシロアリの有翅虫(上)とニンフから分化した幼形生殖虫(ニンフォイド)(下)。スケールバーは1 cm。
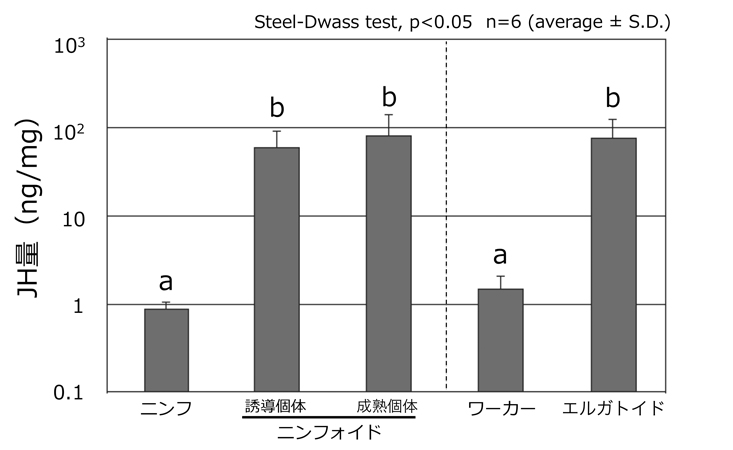
図2.高速液体クロマトグラフ質量分析計を用いて,各個体のJH量を測定した結果。カラム上のアルファベットは,異なる場合に有意差があることを示す。
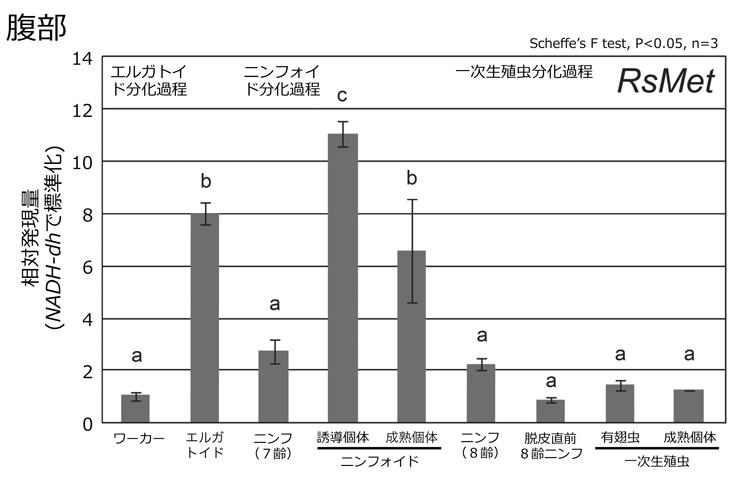
図3.リアルタイム定量PCR法を用いて,本種のJH受容体遺伝子(RsMet)の腹部での発現を解析した結果。ワーカーの発現量を1とした場合の相対値で示す。カラム上のアルファベットは,異なる場合に有意差があることを示す。
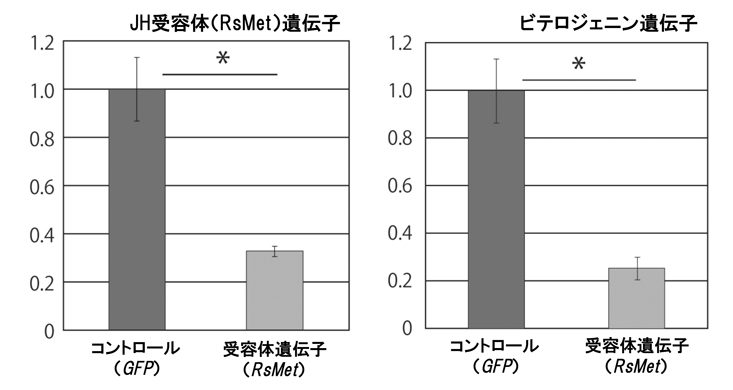
図4.RNA干渉法を用いて,本種のJH受容体遺伝子(RsMet)の機能解析を行った結果。ニンフォイドへの分化前の個体(ニンフ)で,RsMet遺伝子の発現を抑制させた。その結果,分化したニンフォイドのRsMet遺伝子の発現は抑制された(左)。さらに,卵黄前駆タンパク質(ビテロジェニン)遺伝子の発現も抑制された(右)。各グラフのアスタリスクは有意差があることを示す(Welch's t-test, p<0.05)。




